元素的化学性质的周期变化
10 December 2025
元素的化学性质的周期变化
①元素周期表的周期与族
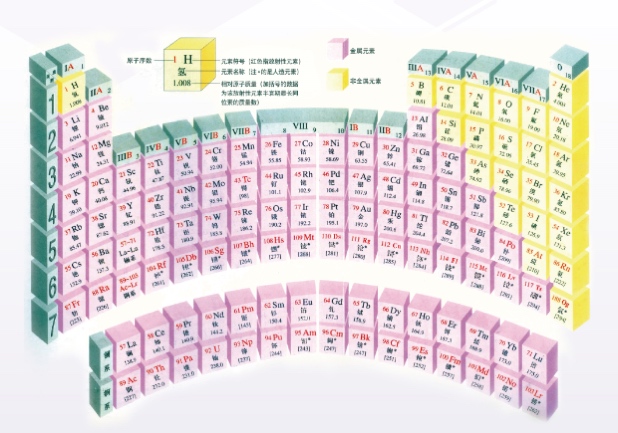
- 现行元素周期表的横行称为“周期”,纵列称为“族”,周期表共有七主族、七副族以及VIII族、0族。这些分区体现着元素性质的周期性变化规律,即元素周期律。
②原子半径的周期变化

- 同一族里,原子半径从上至下依次增大(5、6周期间的副族除外);
- 同一周期里,原子半径从左向右依次减小(稀有气体元素除外)。
③核外电子的周期排布
元素的核外电子受到如下条件限制:
各电子层最多容纳的电子数为2n2个(n为电子层数); 最外层电子数不超过8个(只有一层电子时,电子数不超过2个),次外层不超过18个。
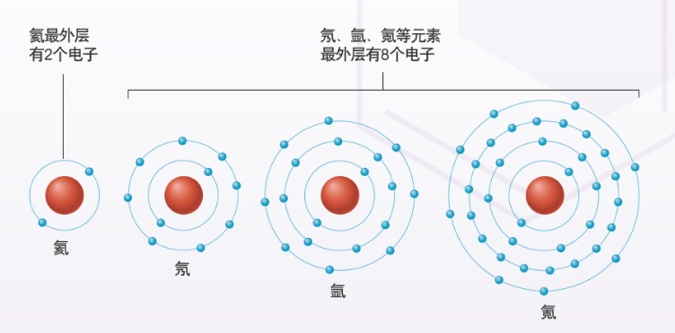
- 同一族的元素,最外层电子数相同,电子层数从上向下递增;
- 同一周期的元素,电子层数相同,最外层电子数从左向右递增。
- 元素间的化学反应,实际上是原子得失或共用电子的过程。元素在反应时,会倾向于通过得失或共用电子,达到最外层8个电子数(氢趋向于达到2个或失去全部电子)。
- 因此,最外层电子数越多,越容易得到电子,最外层电子数越少,越容易失去电子。
④得失电子与金属性、非金属性
元素得失电子的能力,被称为非金属性和金属性。 金属性是指元素失去电子的能力,失电子能力越强的元素金属性就越强。 非金属性是指元素得到电子的能力,得电子能力越强的元素非金属性就越强。

- 在每一族:从上到下,随着原子序数的递增,元素原子半径递增,金属性递增,非金属性递减。
- 在每一周期(不包括0族),从左到右,随着原子序数的递增,元素原子半径递减,最外层电子数递增,金属性递减,非金属性递增。
⑤化合价的周期性变化
化合价就是元素原子得失电子的数量表现。元素的主要化合价也呈现周期性变化。
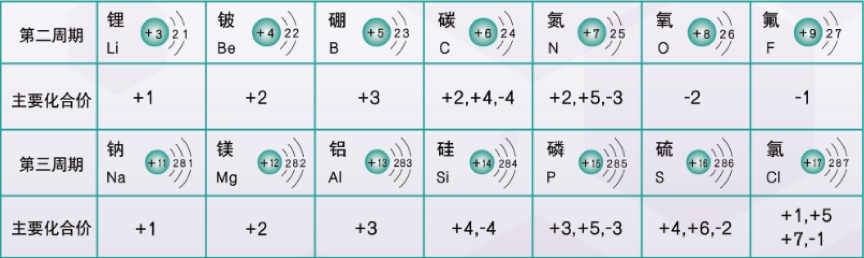
- 最高正价=最外层电子数
- 最低负价=最外层电子数-8
- 每一族的元素,最外层电子数相同,最高正价、最低负价均相同(ⅥA、ⅦA、0族除外)。
- 同一周期的元素(不包括0族),从左到右,最高正价从+1开始依次增加,最低负价从-4开始依次减少。
核外电子排布
1、原子核外有很大空间,电子在这个空间里作高速运动 2、核外电子的分层运动叫做分层排布 3、离核近的电子能量低,离核远的电子能量高
核外电子排布规律
- (1)核外电子是分层排列的,从里到外1,2,3,4,5,6,7,最多7层。
- (2)第一层最多2个电子,第二层最多8个电子,当电子层超过三层时,倒数第二层不超过18个电子;当电子层超过四层时,倒数第三层最多不超过32个电子,最外层不超过8个电子。
- (3)最外层8个电子的结构叫做稳定结构(特殊的是稀有气体中的氦是最外层2个电子)。
- (4)金属原子最外层电子数<4易失电子。
- (5)每层最多排2×(n)^2个电子(n表示层数)
- (6)非金属原子最外层电子数≥4 容易得到电子. 化学性质不稳定
- (7)稀有气体最外层电子数是8个. He:(2个)不得不失(达到最稳定状态,所以稀有气体性质较稳定)。
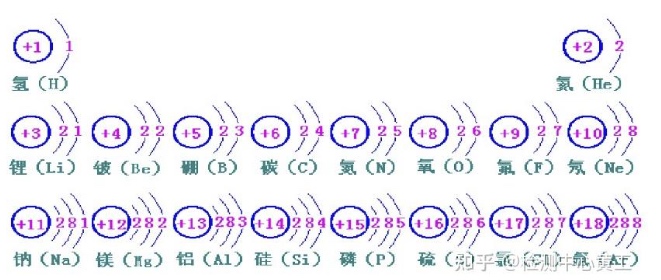
前20号元素的原子结构
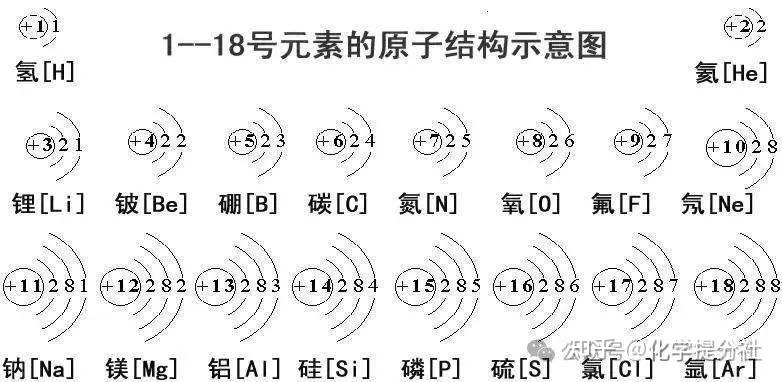
元素周期表的分区

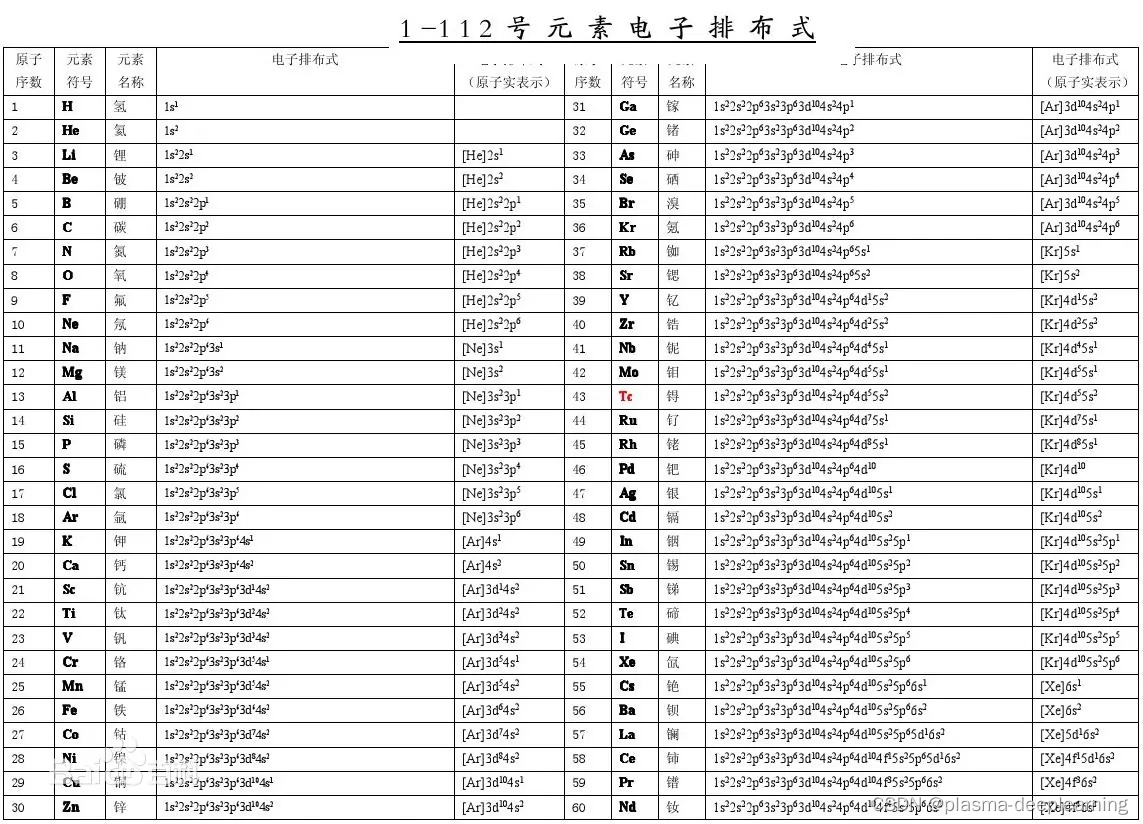
1-112号元素的电子排布